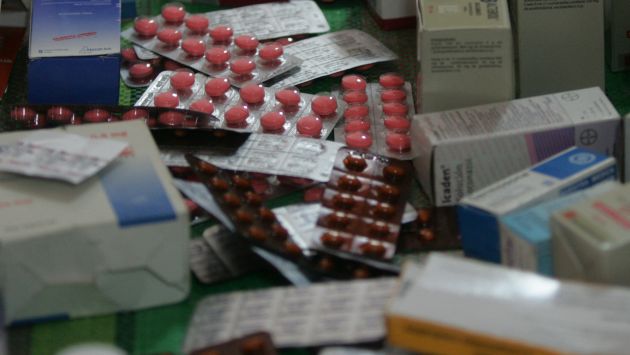
El presidente de la Asociación Médica Peruana, Herberth Cuba, remarcó que las tan esperadas directivas que regulan el ingreso de productos biológicos y biosimilares al país demorarían nueve años en aplicarse.
Explicó que, desde el 2009, la Ley de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios señalaba que para otorgar registros sanitarios a los productos biológicos se debía realizar evaluaciones previas de seguridad y eficacia, las cuales, según dijo, no se han estado dando por la falta de directivas en la regulación sanitaria.
“Han transcurrido cinco años (desde el 2009 al 2014) para que se dé la pre publicación de las directivas que regulan el ingreso de productos biológicos y biosimilares al país. Sin embargo, al leerlas nos hemos llevado la desagradable sorpresa de que las disposiciones transitorias suspenderían su aplicación por cuatro años más”, advirtió.
El representante indicó que en ese tiempo han estado ingresando medicamentos biosimilares sin garantía de calidad, seguridad y eficacia, atentado contra la salud de los miles de pacientes que se tratan con este tipo de medicamentos.
“No entendemos por qué las directivas ahora buscan proteger durante cuatro años más a los intentos de copia de productos biológicos, prolongando a 9 años la comercialización de medicamentos sin comprobada calidad, seguridad y eficacia, poniendo en riesgo la salud de los peruanos”, remarcó.
Si te interesó lo que acabas de leer, recuerda que puedes seguir nuestras últimas publicaciones por Facebook, Twitter y puedes suscribirte aquí a nuestro newsletter.











![Los personajes más recordados de Melania Urbina en el cine peruano [Fotos]](http://cde.peru21.pe/ima/0/0/4/4/3/thumb/443120.jpg)
![Esta empresa tiene gatos en sus oficinas para desestresar a sus trabajadores [FOTOS y VIDEO]](http://cde.peru21.pe/ima/0/0/4/6/6/thumb/466759.jpg)



![Atentado en Barcelona: Estas son las portadas de la tragedia [FOTOS]](http://cde.peru21.pe/ima/0/0/4/9/4/thumb/494145.jpg)
![Estos son los 8 atentados más terribles atribuidos al Estado Islámico [FOTOS]](http://cde.peru21.pe/ima/0/0/4/9/4/thumb/494176.jpg)


